Nature | 组蛋白H4通过诱导溶解性细胞死亡参与慢性炎症
全亚竹
北京大学基础医学院药理学系
本文标题为“Externalized Histone H4 Orchestrates Chronic Inflammation by Inducing Lytic Cell Death”,于2019年5月发表于Nature期刊。其通讯作者为来自德国慕尼黑LMU心血管预防研究所(IPEK)的Oliver Soehnlein和Carlos Silvestre-Roi,第一作者是Carlos Silvestre-Roig。
动脉粥样硬化是常见的心血管疾病,目前已成为人类致残和死亡的主要原因之一。其中,动脉粥样硬化斑块破裂是引发急性心血管事件的主要触发因素。在稳定的动脉粥样硬化斑块中,平滑肌细胞(SMCs)是纤维帽的主要成分之一,并通过产生弹性蛋白、胶原蛋白和其他基质成分增厚纤维帽,使斑块不容易破裂。在斑块失稳过程中,纤维帽内的SMCs凋亡增加,导致细胞外基质生成减少,伴随着炎性细胞的增多与坏死核心的扩大,使得斑块愈加不稳定。Carlos Silvestre-Roig等人发现组蛋白H4可介导平滑肌细胞的裂解,加重炎症与坏死核心的形成,促进斑块不稳定。研究表明,斑块中激活的平滑肌细胞吸引中性粒细胞,触发含有核蛋白的中性粒细胞胞外陷阱(neutrophil extracellular traps, NETs)的排出。阻断组蛋白H4的裂解作用可防止SMCs死亡并稳定动脉粥样硬化病变。
他们首先研究了斑块内中性粒细胞对平滑肌细胞存活的影响,结果显示损伤区域的中性粒细胞的数目和损伤区域面积、坏死核心大小和整体易损性呈正相关,与SMC细胞数量、纤维帽厚度和斑块稳定性负相关。为了确定中性粒细胞浸润、SMC死亡与斑块稳定性之间的因果关系,作者使用药物干预和遗传突变的方法诱导中性粒细胞持续性减少,这进一步导致了SMCs含量和斑块稳定性的增加;相反,中性粒细胞的增多则加剧了斑块的失稳。此外,作者发现损伤处中性粒细胞与SMC临近,提示这两种细胞可能存在直接的相互作用。
中性粒细胞杀伤靶细胞的方式分为两种:直接吞噬病原体或释放NETs。NETs是一种存在于细胞外的大型网状结构,它的骨架是染色质,其上附着组蛋白,颗粒蛋白和髓过氧化物酶和一些胞质蛋白等。作者发现NETs的释放是中性粒细胞杀伤SMCs的主要方式,激活的SMCs能够通过释放趋化因子CCL2和CCL7诱发中性粒细胞NETs的释放,而阻断NETs的释放能够削弱中性粒细胞对SMCs的杀伤。通过使用抗体阻断法,作者确定了NETs中的组蛋白H4可与细胞膜结合,并在细胞膜上形成孔道,造成细胞裂解,实现对细胞的杀伤。
SMCs细胞膜的明显破坏与组蛋白H4诱导的细胞快速死亡促使作者进一步研究了组蛋白H4介导的膜渗透的生物物理学基础。在原子力显微镜下观察发现,用组蛋白H4孵育的人工重构双层膜显示出“孔洞”的出现,这是膜发生动态弯曲的结果。细胞膜产生负高斯曲率是其能够发生穿孔、起泡、出芽或是囊泡化的必要条件。作者通过计算机分析等方法,表明组蛋白H4的N末端具有高σ分数,这个得分与膜形成小孔所需的产生负高斯曲率的能力相关。X射线散射实验的结果也表明,与组蛋白H4的N末端共孵育的小囊泡会发生显著的、剂量依赖性的膜变形,并且这些膜变形具有明显的负高斯曲率。基于此,作者筛选了一种组蛋白抑制肽——环状肽HIPe,它能够与组蛋白H4的N端相互作用,阻碍H4与细胞膜的结合。对患有动脉粥样硬化病变的小鼠连续给予HIPe后,小鼠斑块内的SMCs含量增加,斑块稳定性增强,表明HIPe 对动脉粥样硬化斑块起有效的保护作用。
综上所述,本文研究了动脉粥样硬化损伤区域内SMCs的死亡方式:趋化的中性粒细胞释放NETs,其中的组蛋白H4的N末端与SMCs的细胞膜表面结合,形成孔道,破坏细胞膜,从而裂解SMCs。阻断组蛋白H4的N末端的功能可保护SMCs并稳定斑块,为临床治疗提供新的靶点。
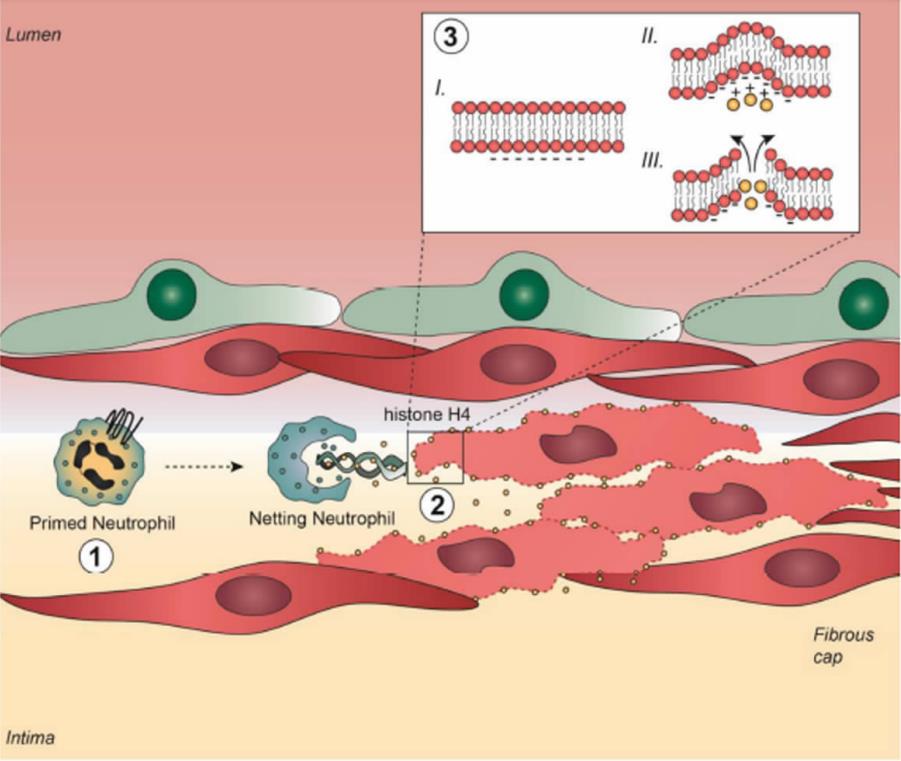
图:中性粒细胞在易损斑块中的细胞毒作用。①斑块中SMCs与中性粒细胞相互作用,诱发NETosis,②NETs释放组蛋白H4与SMCs细胞膜结合。③组蛋白H4的N端结构域的阳离子性诱导质膜弯曲和孔隙形成,导致SMCs裂解。SMCs的死亡促进了纤维帽的变薄与斑块不稳定性。
(转载自中国药理通讯2021年第三十八卷第一期,页码:34-35)